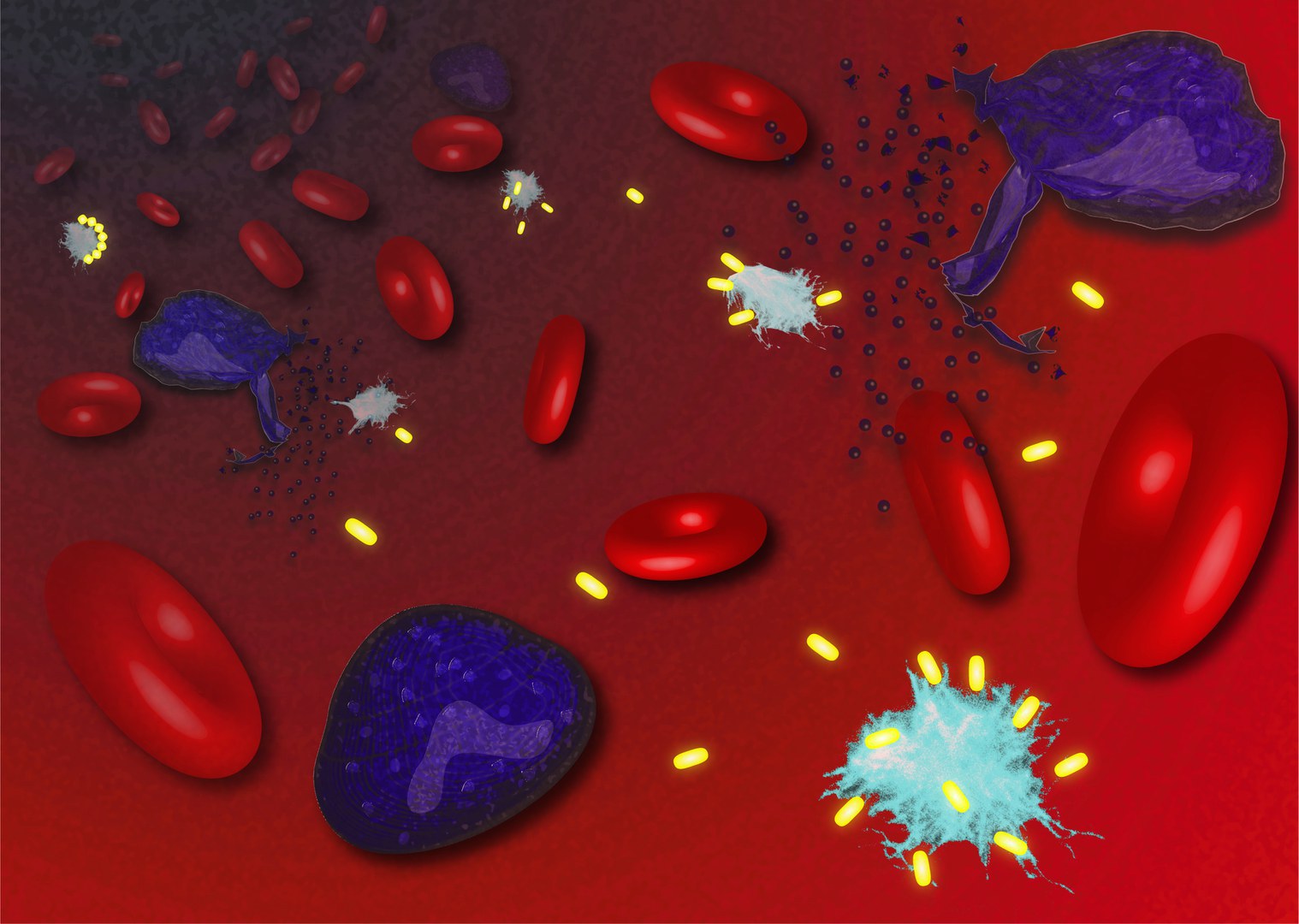
Nicht nur die Villen der Reichen und Schönen verfügen über einen direkten Draht zur Polizei. Auch die Zellen in unserem Körper besitzen eine ausgeklügelte Alarmanlage, das Inflammasom. Seine zentrale Komponente ist das sogenannte ASC-Molekül. Bei Gefahr – etwa der Attacke eines Krankheitserregers – verbünden sich viele dieser Eiweiß-Verbindungen zu einem großen Komplex, dem ASC-Speck. Dieser sorgt für zweierlei: Erstens häufen sich durch seine Aktivität in der Zelle massenhaft Botenstoffe an, mit denen sie das Immunsystem zur Hilfe rufen kann. Und zweitens werden in der Zellmembran zahlreiche Poren gebildet, durch die diese Warnmoleküle nach außen gelangen und ihre Aufgabe erfüllen können.
Letzter Hilfeschrei der sterbenden Zelle
Diese Löcher führen letztlich zum Untergang der Zelle: „Irgendwann explodiert sie geradezu und entleert ihren kompletten Inhalt ins Gewebe“, erklärt Prof. Dr. Bernardo Franklin vom Institut für angeborene Immunität am Universitätsklinikum Bonn. „Die nun schlagartig ausgeschütteten Botenstoffe wirken dann wie ein letzter großer Hilfeschrei. Das Immunsystem wird dadurch zu einer starken Entzündungsreaktion veranlasst, die die Infektion eindämmt.“ Daher ist dieser Mechanismus der angeborenen Immunabwehr auch immens wichtig.
Allerdings gelangen dabei auch ASC-Specks ins Gewebe und können dort unter Umständen lange überdauern. „Wir konnten nun in Mäusen zeigen, dass sie durch ihre Aktivität auch nach Abwehr der Gefahr das Immunsystem aktivieren“, sagt Franklin. „Folge können chronische Entzündungen sein, die das Gewebe stark schädigen.“ Zusammen mit Forschenden der Universität Sao Paulo ist es Franklins Arbeitsgruppe gelungen, diesen unerwünschten Effekt zu unterbinden. Dazu nutzten sie sogenannte Nanobodies.
Bei diesen Wirkstoffen handelt es sich um Antikörper-Fragmente, die sehr simpel aufgebaut sind. „In Zusammenarbeit mit Prof. Dr. Florian Schmidt vom Institut für Angeborene Immunität haben wir Nanobodies erzeugt, die spezifisch gegen ASC wirken und die Specks auflösen können“, erklärt Franklins Mitarbeiter Dr. Damien Bertheloot. Die Forschenden holten sich dazu Schützenhilfe bei einem Alpaka: Sie injizierten dem Tier das ASC-Protein, so dass es dazu passende Antikörper entwickelte. Ein Teil der Alpaka-Antikörper ist sehr einfach aufgebaut. Dies erlaubt es, Fragmente dieser Antikörper als sogenannte Nanobodies herzustellen und zu testen.
Rheuma- und Gicht-Symptome bei Mäusen gelindert
Aus Blutproben des Tiers konnten die Forschenden mit einem aufwändigen Verfahren die genetische Information für die ASC-Nanobodies gewinnen. „Diese Erbanlage haben wir dann in Bakterien eingebaut, so dass wir den Nanobody in großen Mengen von ihnen produzieren lassen konnten“, erläutert Bertheloot. Den Beweis, dass der Wirkstoff ASC-Specks auflösen kann, erbrachte das Team an menschlichen Zellkulturen, aber auch an Mäusen. „In unseren Experimenten haben die Mäuse Rheuma- und Gicht-ähnliche Beschwerden“, erklärt Bertheloot. „Nach Gabe des Nanobodies verbesserte sich die Entzündung und auch der Gesundheitszustand der Nager erheblich.“
Nanobodies sind im Vergleich zu normalen Antikörpern sehr klein. Daher eignen sie sich ausgezeichnet, um derartige Molekülkomplexe aufzulösen. Sie können nämlich auch noch an Stellen gelangen, an denen es für große Wirkstoffe zu eng wäre. Zudem stimulieren normale Antikörper das Immunsystem zusätzlich und können daher eine Entzündung noch verstärken – eine Eigenschaft, die Nanobodies fehlt.
Interessant sind die Ergebnisse auch aus einem weiteren Grund: Studien weisen darauf hin, dass ASC-Specks auch im Gehirn erheblichen Schaden anrichten können. Dort scheinen sie als eine Art „Kristallisationskeim“ für das Protein Aß zu dienen. Im Gehirn von Alzheimer-Patienten verklumpt Aß zu großen Eiweiß-Komplexen, den Plaques. Vermutlich können ASC-Specks diese Verklumpung auslösen. „Vielleicht ist es daher möglich, diesen Vorgang mithilfe unserer Nanobodies zu verlangsamen“, hofft Franklin, Mitglied im Exzellenzcluster ImmunoSensation2 der Universität Bonn. „Wir wollen diese Möglichkeit nun in einer Folgestudie untersuchen.“
Allerdings warnt er zugleich vor zu hochgesteckten Erwartungen: Bis die Ergebnisse möglicherweise in neue Medikamente münden, werden selbst im Idealfall noch Jahre vergehen.
Beteiligte Institutionen:
An der Studie waren am Universitätsklinikum Bonn das Institut für Angeborene Immunität sowie die Nanobody Core Facility beteiligt. Partner seitens der Universität Sao Paulo waren das Zentrum zur Erforschung entzündlicher Erkrankungen sowie die Abteilung für Pharmakologie.
Publikation: Damien Bertheloot et al.: Nanobodies dismantle post-pyroptotic ASC specks and counteract inflammation in vivo; EMBO Molecular Medicine; DOI: https://doi.org/10.15252/emmm.2021154151
KONTAKT:
Prof. Dr. Bernardo S Franklin
Institut für Angeborene Immunität, Universitätsklinikum Bonn
Tel: +49 228/287-51981
E-Mail: franklin@uni-bonn.de