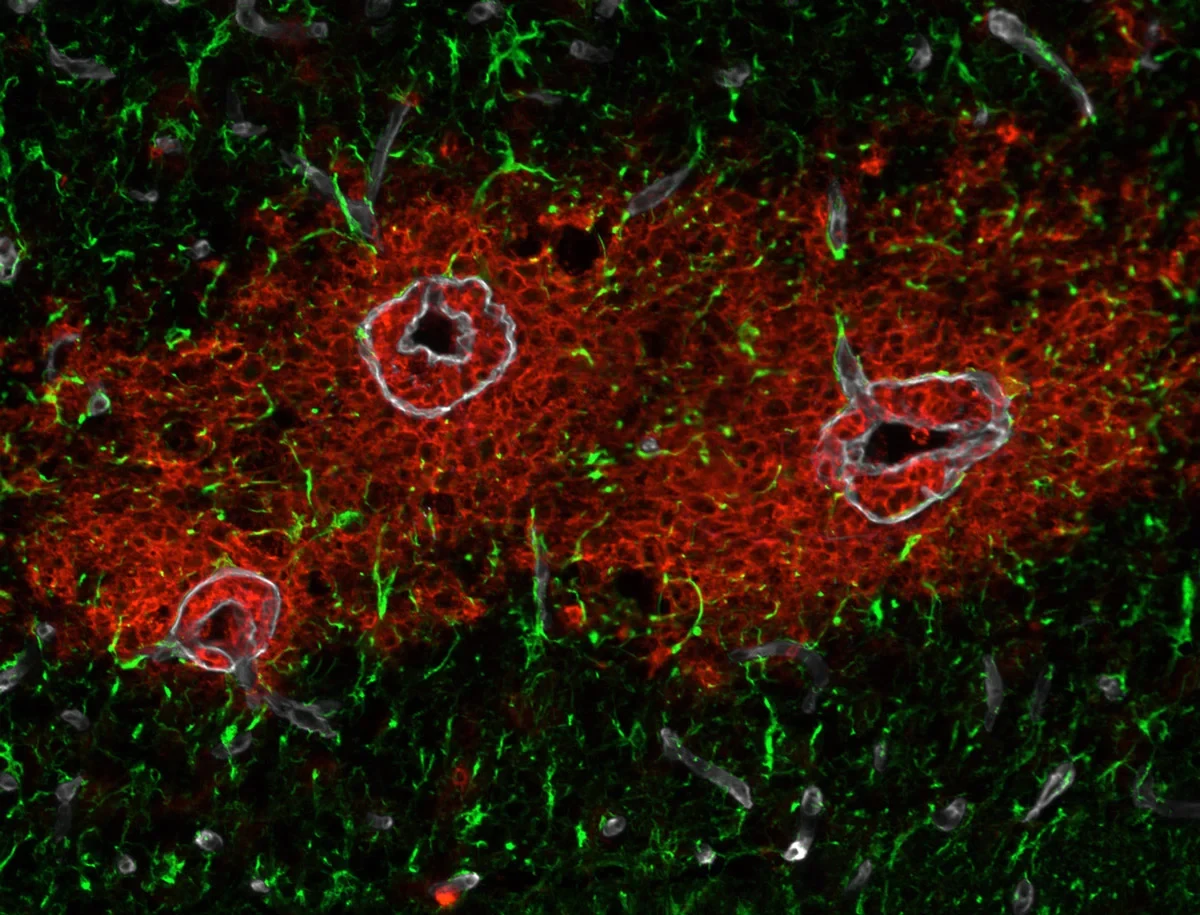
Die Endothelzellen an der Innenwand zerebrale Blutgefäße bilden über eng verknüpfte Verbindungsstellen, so genannte Tight Junctions, eine das Gehirn schützende Barriere. Ohne die darunterliegenden Astrozyten, eine Form von Gliazellen, kann sich jedoch keine voll funktionsfähige Blut-Hirn-Schranke (BHS) bilden. Bei der Neuroinflammation sind die Endothel- und die Astroglia-Schicht molekular und funktionell zwei unterschiedliche Barrieren für eindringende weiße Blutkörperchen, so genannte Leukozyten. Studien zu Multiple Sklerose (MS) zeigen, dass sich Krankheitssymptome aber erst entwickeln, wenn die Immunzellen auch die Astroglia-Schicht durchdrungen haben. „Das unterstreicht ihren wichtigen Beitrag zur funktionellen Unversehrtheit der BHS sowie ihre Unabhängigkeit von der Endothelbarriere“, sagt Prof. Lydia Sorokin, Direktorin des Instituts für Physiologische Chemie und Pathobiochemie an der Universität Münster. „Doch im Gegensatz zur Leukozytenpenetration der Endothelbarriere gab es bisher wenig Kenntnis über nachfolgende Prozesse an der Astroglia-Schicht.“
Datenlage zu Prozessen an der Zelloberfläche von Astrozyten ist dünn
Es ist bekannt, dass die Gelatinasen, Matrix-Metalloproteinase (MMP)-2 und -9 das Eindringen von Leukozyten ins Gehirns bei Neuroinflammation regeln. Eine Aktivität dieser beiden Proteinspaltenden Enzyme ist somit ein früher Marker für das Eindringen dieser Immunzellen in das Hirnparenchym – bisher der einzige spezifische Marker für eine laufende Neuroinflammation. „Es gibt Hinweise darauf, dass MMP-2 und MMP-9 sowohl positive als auch negative Auswirkungen auf die BHS haben. Daher wird die Entschlüsselung ihrer Substratspezifität an der Hirnparenchymgrenze zum Verständnis der molekularen Prozesse beitragen, die essentiell für die astrogliale Barrierefunktion sind“, sagt Prof. Sorokin.
Sekretomic ist der Schlüssel zu Peptiden aus proteolytischer Spaltung
Die Identifizierung der Enzym-Spaltstellen ist eine Herausforderung. Das Forscherteam setzt dabei auf jüngste Fortschritte unter anderem in der Massenspektrometrie (MS) zur Analyse des Sekretoms – eine Methode, mit der von Zellen abgesonderte Proteine umfassend detektiert werden können. In dieser Studie entwickelten sie diese Methode weiter, um proteolytische Spaltungen von Zellmembran-assoziierten Proteinen zu identifizieren. „Unser Ansatz weist extrazellulär freigesetzte Proteinfragmente unabhängig von biochemischen Anreicherungen nach und ist daher besonders empfindlich“, sagt Prof. Felix Meissner, Direktor des Instituts für Angeborene Immunität des UKB. Mithilfe eines maßgeschneiderten Sekretom-MS-Ansatzes identifizierte das Team zwei Hauptklassen von Verbindungen, die durch MMP-2/MMP-9von der Astrozyten-Zelloberfläche freigesetzt werden. Validiert wurden diese neuen Substrate der Neuroinflammation im Maus-Model von Multipler Sklerose und in menschlichen MS-Proben.
Insgesamt liefert die Kombination des Sekretom-MS-Ansatzes mit Kenntnissen über die astrogliale Barriere eine einzigartige Datenbank bisher unbekannter Gelatinase-Substrate, die wahrscheinlich zur Barrierefunktion der astroglialen Grenze beitragen. Zudem deutet vieles darauf hin, dass die MMP-2/MMP-9-Aktivität auch die Kommunikation zwischen Astrozyten und Neuronen beeinflussen kann. „Unser Ansatz zur Identifizierung von proteolytischen Prozessen, die die astrogliale Barrierefunktion steuern, funktioniert und bietet Möglichkeiten für zukünftige Forschungen zum Verständnis der molekularen Natur der Astroglia-Barriere und ihres Beitrags zur BHS“, sagt Prof. Meissner.